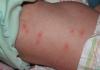
La chimica è una materia affascinante ma difficile. E se la scuola non aveva ancora accessori per condurre esperimenti, allora possiamo dire che è completamente passata. Ma c'è qualcosa in cui ogni persona dovrebbe essere almeno minimamente orientata. Questa è la tavola periodica.
Per gli scolari, impararlo è una vera tortura. Se la vedono nei sogni, allora solo incubi. Tanti elementi, ognuno ha il suo numero... Ma una madre di tanti bambini ha inventato un modo divertente, come imparare la tavola periodica. È adatto sia per bambini che per adulti e la reazione te ne parlerà volentieri "Così semplice!".

Tavola periodica degli elementi chimici
Come ha dimostrato Karin Tripp, madre di quattro figli, con il giusto approccio è possibile imparare qualsiasi cosa. Attaccarsi studio di chimica anche bambini piccoli, decise di trasformare la tavola periodica degli elementi in un campo di battaglia navale.

Il gioco contiene quattro pagine con la tavola periodica, due per ogni giocatore. Ogni giocatore deve disegnare le sue navi su un tavolo e sull'altro - per designare i suoi colpi e le navi nemiche distrutte con i punti.

Le regole del combattimento navale sono le stesse del gioco classico. Solo per abbattere la barca dell'avversario, devi nominare non la lettera e il numero, ma l'elemento chimico corrispondente.

Questa tecnica consentirà ai bambini non solo di imparare i nomi degli elementi chimici. Promuove lo sviluppo della memoria e del pensiero logico. Dopotutto, i bambini analizzeranno numeri di serie e colori.

Per rendere più facile per i bambini trovare all'inizio l'elemento desiderato, le righe e le colonne dovrebbero essere numerate con numeri. Ma, secondo Karin, dopo alcuni giorni passati a giocare alla "battaglia navale chimica", i suoi figli hanno iniziato a navigare perfettamente nella tavola periodica. Conoscevano persino le masse atomiche e i numeri di serie degli elementi.

Nel tempo, le regole del gioco possono essere complicate. Ad esempio, posiziona la nave solo all'interno di una famiglia di elementi chimici.

Anche la figlia di otto anni di una madre inventiva che non ha ancora studiato chimica a scuola gioca a questo gioco con piacere. E per gli adulti, questo è un ottimo modo per divertirsi.

Tutte le pagine della tavola periodica per giocare a battaglie navali possono essere stampate su una stampante normale oa colori e utilizzate un numero illimitato di volte.

Compiti a casa non standard in poi chimica. Componiamo la Tavola Periodica dalle carte pescate.
Argomento compiti: disegnare una carta di un elemento chimico separato presente negli organismi viventi (biogen) con un'illustrazione del suo effetto sugli organismi viventi.
Classe - 8- Grado 10; complessità- alto, interdisciplinare; volta prestazione - 30-40 minuti.
Tipo di lavoro - individuo, e poi - in un gruppo; metodo di verifica- raccogliere illustrazioni di singoli elementi chimici in formato A4, e da esse compilare una tavola periodica generale.
Esercitazioni:
1) Libro di chimica grado 10 - O.S. Gabrielyan, I.G. Ostroumov, S.Yu. Ponomarev, livello avanzato (CAPITOLO 7. Composti biologicamente attivi, p. 300).
2) Libro di chimica grado 8 - O.S. Gabrielyan, (§ 5. Sistema periodico di elementi chimici di D. I. Mendeleev. Segni di elementi chimici, p. 29).
3) libro di testo di ecologia grado 10 (11) - E. A. Kriksunov, V. V. Pasechnik, (Capitolo 6. Ambiente e salute umana, 6.1. Inquinamento chimico dell'ambiente e salute umana, p. 217).
4) manuale di biologia classe 10-11 - Biologia generale. Un livello base di. ed. Belyaeva DK, Dymshitsa G.M. (Capitolo 1. Composizione chimica della cellula. § 1. Composti inorganici, § 2. Biopolimeri.).
Obiettivi: sviluppo delle conoscenze sui processi biochimici in una cellula vivente, processi geochimici in natura, ottenuti dagli scolari in modo indipendente e significativo, fissati da un disegno, disegno creativo. Crea ausili visivi unici per altri studenti. Compilazione dell'esclusivo "Tavolo di Mendeleev" dell'autore.
Nota esplicativa.
L'essenza dei compiti in quanto gli studenti traggono la partecipazione di ciascun elemento chimico ai processi geochimici. E poi tutti i disegni vengono combinati in un riassunto "Il tavolo di Mendeleev", che può essere appeso al muro dell'aula. Si forma un certo prodotto visivo della creatività congiunta: "L'ecologia nelle immagini". In classi diverse si ottengono "tabelle di Mendeleev" diverse, l'importante è mantenere la forma tabellare e assicurarsi che tutti i disegni siano su un foglio A4. E inoltre, in modo che nell'angolo del foglio venga apposto il segno chimico dell'elemento su cui è disegnata la trama. In primo luogo, ogni studente sceglie un elemento chimico specifico da studiare. Quindi, da solo o con l'aiuto di un insegnante, ricerca le informazioni, seleziona le informazioni necessarie, inventa la trama del disegno, disegna e posiziona il suo disegno sul muro nella cella della tavola periodica speculativa per la sostanza chimica corrispondente elemento. Puoi semplificare / complicare il compito scegliendo solo il più comune sulla terra tra tutti gli elementi chimici o, al contrario, il meno comune. Puoi selezionare solo biogeni (elementi chimici che compongono gli organismi viventi) e disegnare schede di lezione con storie su di loro. Puoi scegliere macroelementi di cellule viventi, oppure puoi scegliere solo microelementi, ecc. Nei libri di riferimento ambientale ora puoi trovare molte informazioni diverse su questo argomento.
Materiale di riferimento: I biogeni sono elementi chimici che sono costantemente presenti negli organismi viventi e svolgono qualsiasi ruolo biologico: O, C, H, Ca, N, K, P, Mg, S, Cl, Na, Fe, io, cu.
Il "tavolo di Mendeleev" virtuale. Invece di un tavolo di carta sul muro dell'aula, puoi organizzare un tavolo virtuale e il lavoro generale degli studenti al suo interno. Per fare ciò, l'insegnante prepara un layout del tavolo in Google -documenti e fornisce l'accesso agli studenti. Gli studenti possono disegnare utilizzando programmi per computer, oppure possono caricare disegni realizzati con matite e colori. Ecco la disposizione originale di tale tabella, parzialmente completata dagli studenti.
Schede di studio separate , con schizzi degli studenti sull'impatto di specifici elementi chimici sugli organismi viventi (formato A4 di ogni scheda).












APPENDICE. Tabella degli elementi chimici-biogeni, come materiale di riferimento per disegnare le trame delle carte educative.
| Concentrazioni soglia di elementi chimici nel suolo (mg/kg) e possibili reazioni degli organismi (secondo Kowalski) |
|||
| Elemento chimico | Svantaggio: concentrazione soglia inferiore | Norma | Eccesso - concentrazione di soglia superiore |
| Cobalto | Meno di 2-7. Anemia, ipo e avitominosi B, gozzo endemico. | 7-30 | Più di 30. Inibizione della sintesi della vitamina B. |
| Rame | Meno di 6-13. Anemia, malattie dell'apparato scheletrico. Mancata maturazione dei cereali, appassimento degli alberi da frutto. | 13-60 | Più di 60. Danni al fegato, anemia, ittero. |
| Manganese | Fino a 400. Malattia ossea, gozzo ingrossato. | 400-3000 | Più di 3000. Malattie dell'apparato scheletrico. |
| Zinco | Fino a 30. Crescita nana di piante e animali. | 30-70 | Più di 70. Inibizione dei processi ossidativi, anemia |
| Molibdeno | Fino a 1,5. Malattie delle piante. | 1,5-4 | Più di 4. Gotta nell'uomo, tossicosi da molibdeno negli animali. |
| Bor | Meno di 3-6. Morte dei punti di crescita degli steli e delle radici delle piante. | 6-30 | Più di 30. Diarrea da boro (enterite) negli animali. |
| Stronzio | Più di 600. Malattia di Urov, rachitismo, ossa fragili. |
||
| Iodio | Meno di 2-5. Gozzo endemico nell'uomo | 5-40 | Più di 40. Indebolimento della sintesi dei composti di iodio della tiroide. |
Il 1 marzo 1869 Mendeleev completò il suo lavoro "Esperienza di un sistema di elementi basato sul loro peso atomico e somiglianza chimica". Questo giorno è considerato il giorno della scoperta della legge periodica degli elementi da parte del D.M. Mendeleev. "La scoperta di DI Mendeleev si riferisce alle leggi fondamentali dell'universo, come la legge di gravitazione universale di Newton o la teoria della relatività di Einstein, e DM Mendeleev è alla pari con i nomi di questi grandi fisici". Accademico A.I. Rusanov.
"Il sistema periodico è stato e rimane la principale stella polare nelle ultime soluzioni al problema della materia". prof. AN Reformatsky.
"Quando ti avvicini alla valutazione di personalità come DI Mendeleev, all'analisi della loro creatività scientifica, senti involontariamente il desiderio di trovare in questa creatività gli elementi che più sono contrassegnati dal marchio del genio. Di tutti i segni che contraddistinguono il genio e la sua manifestazione, due, a quanto pare, sono le più eloquenti: questa, in primo luogo, la capacità di coprire e combinare vasti ambiti della conoscenza e, in secondo luogo, la capacità di saltare bruscamente nel pensiero, a inaspettate convergenze di fatti e concetti che per un i mortali sembrano lontani e non imparentati, almeno fino a quando una tale connessione non sarà scoperta e provata." LA Chugaev, professore di chimica.
Sì, e lo stesso Mendeleev ha capito la grande importanza della legge che ha scoperto per la scienza. E credevo nel suo ulteriore sviluppo. "Secondo la legge periodica, il futuro non minaccia la distruzione, ma promette solo sovrastrutture e sviluppo". DI. Mendeleev.
La vista originale della tavola, scritta da D.I. Mendeleev.
Se tutta la conoscenza scientifica del mondo scomparisse a causa di una sorta di cataclisma, per la rinascita della civiltà, una delle leggi principali sarebbe la legge periodica di D.I. Mendeleev. I successi della fisica atomica, compresa l'energia nucleare e la sintesi di elementi artificiali, divennero possibili solo grazie alla Legge Periodica. A loro volta, hanno ampliato e approfondito l'essenza della legge di Mendeleev.
La legge periodica ha svolto un ruolo enorme nello sviluppo della chimica e di altre scienze naturali. È stata scoperta la relazione reciproca tra tutti gli elementi, le loro proprietà fisiche e chimiche. Ciò poneva dinanzi alle scienze naturali un problema scientifico e filosofico di grande importanza: questo nesso reciproco va spiegato.
La scoperta della legge periodica è stata preceduta da 15 anni di duro lavoro. Quando fu scoperta la legge periodica, erano noti 63 elementi chimici, c'erano circa 50 diverse classificazioni. La maggior parte degli scienziati ha confrontato solo elementi simili nelle proprietà tra loro, quindi non sono stati in grado di scoprire la legge. Mendeleev ha confrontato tutto tra loro, inclusi elementi dissimili. Mendeleev annotò sulle carte tutte le informazioni conosciute sugli elementi chimici e sui loro composti scoperti e studiati in quel momento, le dispose in ordine crescente delle loro relative masse atomiche e analizzò in modo completo l'intero set, cercando di trovare determinati schemi in esso. Come risultato di un intenso lavoro creativo, scoprì segmenti di questa catena in cui le proprietà degli elementi chimici e delle sostanze da essi formate cambiavano in modo simile - periodicamente - periodi. Con lo sviluppo della teoria della struttura del guscio elettronico degli atomi, è diventato chiaro perché le proprietà degli atomi mostrano periodicità all'aumentare della massa atomica. Gli atomi con la stessa sfera esterna formano un gruppo. Gli atomi con lo stesso numero di sfere esterne formano una riga. Atomi con nuclei che hanno la stessa carica ma diverse masse hanno le stesse proprietà chimiche ma diversi pesi atomici e sono isotopi dello stesso elemento chimico. In sostanza, le proprietà degli atomi riflettono le proprietà dei gusci di elettroni esterni, che sono strettamente legate alle leggi della fisica quantistica.
La stessa tavola periodica è stata trasformata molte volte, visualizzando diverse informazioni sulle proprietà degli atomi. Ci sono anche tavoli divertenti. 
Il cosiddetto breve periodo o forma abbreviata di TM 

Lungo periodo o forma lunga di TM 
Extra lungo. 
Bandiere di stati che denotano il paese in cui questo elemento è stato scoperto per la prima volta. 
I nomi di elementi cancellati o risultati errati, come la storia del didimio Di - si sono poi rivelati una miscela di due elementi appena scoperti, praseodimio e neodimio. 
Qui gli elementi formatisi durante il Big Bang sono contrassegnati in blu, gli elementi sintetizzati durante la nucleosintesi primaria sono in blu, i colori giallo e verde indicano gli elementi sintetizzati, rispettivamente, negli interni delle stelle "piccole" e "grandi". In rosa - sostanze (nuclei) sintetizzate durante le esplosioni di supernova. A proposito, l'oro (Au) viene ancora sintetizzato durante le collisioni di stelle di neutroni. Viola - creato artificialmente nei laboratori. Ma non è tutta la storia... 
Qui gli elementi organici, inorganici e insostituibili sono indicati in diversi colori, necessari per costruire i corpi degli esseri viventi, noi compresi. 








tavolo della torre
Proposta nel 2006 da Vitaly Zimmerman sulla base delle idee di Charles Janet. Ha studiato il riempimento orbitale degli atomi, il modo in cui gli elettroni sono disposti rispetto al nucleo. E sulla base di ciò, ha diviso tutti gli elementi in quattro gruppi, ordinandoli secondo le configurazioni della posizione degli elettroni. Il tavolo è estremamente semplice e funzionale. 



Tavolo - spirale.
Nel 1964, Theodore Benfey propose di mettere l'idrogeno (H) al centro del tavolo e di posizionare gli altri elementi attorno ad esso in una spirale che si svolge in senso orario. Già al secondo giro, l'elica si allunga in anelli, che corrispondono a metalli di transizione e lantanidi con attinidi, è previsto un posto per superattinidi finora sconosciuti. Questo conferisce al tavolo l'aspetto di una soluzione di design stravagante. 
Tabella - spirale arcobaleno.
Inventato nel 1975 dal chimico James Hyde. Amava i composti organosilicio, quindi era la selce che entrava nella base del tavolo, poiché ha un gran numero di legami con altri elementi. Varie categorie di elementi sono anche raggruppate per settori e contrassegnate con il colore desiderato. Il tavolo è più bello degli analoghi, ma a causa della forma curvilinea non è facile da usare. 






Queste tabelle mostrano la sequenza in cui vengono riempiti i gusci di elettroni. Almeno alcuni di loro. Tutti questi tavoli sembrano molto esotici.
Tabella degli isotopi. Visualizza il tempo di "vita" di vari isotopi, la loro stabilità a seconda della massa del nucleo. Tuttavia, questa non è più la tavola periodica, questa è una storia (fisica nucleare) completamente diversa... 
In effetti, il fisico tedesco Johann Wolfgang Dobereiner notò il raggruppamento di elementi già nel 1817. A quei tempi, i chimici non avevano ancora pienamente compreso la natura degli atomi, come descritto da John Dalton nel 1808. Nel suo "Nuovo sistema di filosofia chimica", Dalton ha spiegato le reazioni chimiche assumendo che ogni sostanza elementare sia composta da un particolare tipo di atomo.
Dalton suggerì che le reazioni chimiche producevano nuove sostanze quando gli atomi venivano separati o combinati. Credeva che ogni elemento consistesse esclusivamente in un tipo di atomo, che differisce dagli altri per peso. Gli atomi di ossigeno pesavano otto volte di più degli atomi di idrogeno. Dalton credeva che gli atomi di carbonio fossero sei volte più pesanti dell'idrogeno. Quando gli elementi si combinano per creare nuove sostanze, la quantità di reagenti può essere calcolata da questi pesi atomici.
Dalton si sbagliava su alcune masse: l'ossigeno è in realtà 16 volte più pesante dell'idrogeno e il carbonio è 12 volte più pesante dell'idrogeno. Ma la sua teoria ha reso utile l'idea degli atomi, ispirando una rivoluzione nella chimica. La misurazione accurata della massa atomica è diventata un grave problema per i chimici nei decenni a venire.
Riflettendo su queste scale, Dobereiner ha notato che alcuni insiemi di tre elementi (li chiamava triadi) mostrano una relazione interessante. Il bromo, ad esempio, aveva una massa atomica compresa tra quella del cloro e dello iodio e tutti e tre questi elementi mostravano un comportamento chimico simile. Anche litio, sodio e potassio erano una triade.
Altri chimici notarono connessioni tra masse atomiche e , ma fu solo negli anni '60 dell'Ottocento che le masse atomiche furono ben comprese e misurate abbastanza da sviluppare una comprensione più profonda. Il chimico inglese John Newlands notò che la disposizione degli elementi conosciuti in ordine di massa atomica crescente portava a una ripetizione delle proprietà chimiche di ogni ottavo elemento. Questo modello ha chiamato la "legge delle ottave" in un documento del 1865. Ma il modello di Newlands non ha resistito molto bene dopo le prime due ottave, portando i critici a suggerire che alfabetizzasse gli elementi. E come si rese presto conto Mendeleev, la relazione tra le proprietà degli elementi e le masse atomiche era un po' più complessa.
Organizzazione degli elementi chimici
Mendeleev nacque a Tobolsk, in Siberia, nel 1834, diciassettesimo figlio dei suoi genitori. Ha vissuto una vita colorata, perseguendo interessi diversi e viaggiando sulla strada di persone eminenti. Mentre riceveva un'istruzione superiore presso l'Istituto Pedagogico di San Pietroburgo, è quasi morto per una grave malattia. Dopo la laurea, ha insegnato nelle scuole superiori (questo era necessario per ricevere uno stipendio presso l'istituto), lungo il percorso studiando matematica e scienze per ottenere un master.
Ha poi lavorato come insegnante e docente (e ha scritto articoli scientifici) fino a quando ha ricevuto una borsa di studio per un lungo tour di ricerca nei migliori laboratori chimici d'Europa.
Tornato a San Pietroburgo, si è ritrovato senza lavoro, quindi ha scritto un'eccellente guida alla programmazione nella speranza di vincere un grosso premio in denaro. Nel 1862 gli valse il Premio Demidov. Ha anche lavorato come editore, traduttore e consulente in vari settori chimici. Nel 1865 tornò alla ricerca, conseguì un dottorato e divenne professore all'Università di San Pietroburgo.
Poco dopo, Mendeleev iniziò a insegnare chimica inorganica. Preparandosi a padroneggiare questo nuovo campo (per lui), era insoddisfatto dei libri di testo disponibili. Così ho deciso di scrivere il mio. L'organizzazione del testo richiedeva l'organizzazione degli elementi, quindi la questione della loro migliore disposizione era costantemente nella sua mente.
All'inizio del 1869, Mendeleev aveva compiuto progressi sufficienti per rendersi conto che alcuni gruppi di elementi simili mostravano un aumento regolare delle masse atomiche; altri elementi con all'incirca le stesse masse atomiche avevano proprietà simili. Si è scoperto che ordinare gli elementi in base al loro peso atomico era la chiave per la loro classificazione.

Tavola periodica di D. Meneleev.
Nelle stesse parole di Mendeleev, ha strutturato il suo pensiero scrivendo ciascuno dei 63 elementi allora conosciuti su una carta separata. Poi, attraverso una specie di gioco di solitario chimico, ha trovato lo schema che stava cercando. Disponendo le carte in colonne verticali con masse atomiche dal basso verso l'alto, ha posizionato elementi con proprietà simili in ogni riga orizzontale. Nasce la tavola periodica di Mendeleev. Ha redatto una bozza il 1 marzo, l'ha inviata alla stampa e l'ha inclusa nel suo libro di testo di prossima pubblicazione. Ha anche preparato rapidamente un documento da presentare alla Russian Chemical Society.
"Gli elementi ordinati in base alla dimensione delle loro masse atomiche mostrano chiare proprietà periodiche", ha scritto Mendeleev nel suo lavoro. "Tutti i confronti che ho fatto mi hanno portato alla conclusione che la dimensione della massa atomica determina la natura degli elementi".
Nel frattempo, anche il chimico tedesco Lothar Meyer stava lavorando all'organizzazione degli elementi. Preparò una tavola simile a quella di Mendeleev, forse anche prima di quella di Mendeleev. Ma Mendeleev pubblicò il suo primo.
Tuttavia, molto più importante della sconfitta di Meyer è stato il modo in cui Mendeleev ha usato il suo tavolo per creare elementi sconosciuti. Nel preparare il suo tavolo, Mendeleev ha notato che mancavano alcune carte. Doveva lasciare spazi vuoti in modo che gli elementi noti potessero allinearsi correttamente. Anche durante la sua vita, tre spazi vuoti furono riempiti con elementi prima sconosciuti: gallio, scandio e germanio.
Mendeleev non solo ha predetto l'esistenza di questi elementi, ma ha anche descritto correttamente le loro proprietà in dettaglio. Il gallio, ad esempio, scoperto nel 1875, aveva una massa atomica di 69,9 e una densità sei volte quella dell'acqua. Mendeleev predisse questo elemento (lo chiamò ekaalluminio) solo da questa densità e massa atomica 68. Le sue previsioni per l'ekasilicon corrispondevano strettamente al germanio (scoperto nel 1886) in massa atomica (72 prevista, 72,3 effettiva) e densità. Ha anche predetto correttamente la densità dei composti del germanio con ossigeno e cloro.
La tavola periodica è diventata profetica. Sembrava che alla fine di questo gioco si sarebbe rivelato questo solitario degli elementi. Allo stesso tempo, lo stesso Mendeleev era un maestro nell'usare il proprio tavolo.
Le previsioni di successo di Mendeleev gli valsero lo status leggendario di maestro della magia chimica. Ma gli storici oggi discutono se la scoperta degli elementi predetti abbia consolidato l'adozione della sua legge periodica. Il passaggio della legge potrebbe aver avuto più a che fare con la sua capacità di spiegare i legami chimici stabiliti. In ogni caso, l'accuratezza predittiva di Mendeleev ha sicuramente attirato l'attenzione sui meriti del suo tavolo.
Entro il 1890, i chimici riconobbero ampiamente la sua legge come una pietra miliare nella conoscenza chimica. Nel 1900, il futuro premio Nobel per la chimica William Ramsay la definì "la più grande generalizzazione che sia mai stata fatta in chimica". E Mendeleev lo fece senza capire come.
mappa matematica
In molti casi nella storia della scienza, grandi previsioni basate su nuove equazioni si sono rivelate corrette. In qualche modo, la matematica rivela alcuni dei segreti della natura prima che gli sperimentatori li scoprano. Un esempio è l'antimateria, un altro è l'espansione dell'universo. Nel caso di Mendeleev, le previsioni di nuovi elementi sono emerse senza alcuna matematica creativa. Ma in effetti, Mendeleev ha scoperto una profonda mappa matematica della natura, poiché la sua tavola rifletteva il significato di , le regole matematiche che governano l'architettura atomica.
Nel suo libro, Mendeleev ha osservato che "le differenze interne nella materia che compongono gli atomi" possono essere responsabili delle proprietà che si ripetono periodicamente. Ma non ha seguito questa linea di pensiero. In effetti, per molti anni ha riflettuto sull'importanza della teoria atomica sul suo tavolo.
Ma altri sono stati in grado di leggere il messaggio interiore della tavola. Nel 1888, il chimico tedesco Johannes Wieslicen annunciò che la periodicità delle proprietà degli elementi ordinate per massa indica che gli atomi sono composti da gruppi regolari di particelle più piccole. Quindi, in un certo senso, la tavola periodica prevedeva (e forniva prove) la complessa struttura interna degli atomi, mentre nessuno aveva la più pallida idea di come fosse effettivamente l'atomo o se avesse una struttura interna.
Al momento della morte di Mendeleev nel 1907, gli scienziati sapevano che gli atomi sono divisi in parti: , più alcuni componenti caricati positivamente che rendono gli atomi elettricamente neutri. La chiave dell'allineamento di queste parti arrivò nel 1911, quando il fisico Ernest Rutherford, che lavorava all'Università di Manchester in Inghilterra, scoprì il nucleo atomico. Poco dopo, Henry Moseley, lavorando con Rutherford, dimostrò che la quantità di carica positiva in un nucleo (il numero di protoni che contiene, o il suo "numero atomico") determina il corretto ordine degli elementi nella tavola periodica.

Henry Moseley.
La massa atomica era strettamente correlata al numero atomico di Moseley, abbastanza vicino che l'ordine degli elementi in base alla massa differiva solo in pochi punti dall'ordinamento in base al numero. Mendeleev ha insistito sul fatto che queste masse avevano torto e dovevano essere misurate di nuovo, e in alcuni casi aveva ragione. Sono rimaste alcune discrepanze, ma il numero atomico di Moseley si adatta perfettamente alla tabella.
Più o meno nello stesso periodo, il fisico danese Niels Bohr si rese conto che la teoria quantistica determinava la disposizione degli elettroni che circondano il nucleo e che gli elettroni più esterni determinavano le proprietà chimiche di un elemento.
Disposizioni simili di elettroni esterni verranno ripetute periodicamente, spiegando gli schemi che la tavola periodica ha originariamente rivelato. Bohr creò la sua versione della tavola nel 1922 basata su misurazioni sperimentali delle energie degli elettroni (insieme ad alcuni indizi dalla legge periodica).
La tavola di Bohr aggiungeva elementi scoperti dal 1869, ma era lo stesso ordine periodico scoperto da Mendeleev. Senza avere la minima idea di ciò, Mendeleev ha creato un tavolo che riflette l'architettura atomica dettata dalla fisica quantistica.
Il nuovo tavolo di Bohr non era né la prima né l'ultima versione del progetto originale di Mendeleev. Da allora sono state sviluppate e pubblicate centinaia di versioni della tavola periodica. La forma moderna - in un design orizzontale in contrasto con la versione verticale originale di Mendeleev - non divenne molto popolare fino a dopo la seconda guerra mondiale, in gran parte grazie al lavoro del chimico americano Glenn Seaborg.
Seaborg ei suoi colleghi hanno creato sinteticamente diversi nuovi elementi, con numeri atomici dopo l'uranio, l'ultimo elemento naturale sul tavolo. Seaborg vide che questi elementi, transuranici (più i tre elementi che hanno preceduto l'uranio), richiedevano una nuova riga nella tabella che Mendeleev non aveva previsto. La tabella di Seaborg ha aggiunto una riga per quegli elementi sotto la riga simile di elementi delle terre rare che non avevano un posto nella tabella.
Il contributo di Seaborg alla chimica gli è valso l'onore di nominare il proprio elemento, seaborgium, numero 106. È uno dei numerosi elementi che prendono il nome da famosi scienziati. E in questa lista, ovviamente, c'è l'elemento 101, scoperto da Seaborg e dai suoi colleghi nel 1955 e chiamato mendelevio - in onore del chimico che, sopra tutti, meritava un posto nella tavola periodica.
Dai un'occhiata al nostro canale di notizie per altre storie come questa.
TAVOLA PERIODICA DEGLI ELEMENTI CHIMICI
La rappresentazione grafica della legge periodica è la tavola periodica. Contiene 7 periodi e 8 gruppi.
La forma abbreviata della tavola D.I. Mendeleev.
Versione semilunga del tavolo D.I. Mendeleev.
Esiste anche una versione lunga del tavolo, è simile a una versione semilunga, ma solo i lantanidi e gli attinidi non vengono rimossi dal tavolo.
Il tavolo originale di D. I. Mendeleev
1. Periodo - elementi chimici disposti in linea (1 - 7)
Piccolo (1, 2, 3) - sono costituiti da una riga di elementi
Larga (4, 5, 6, 7) - composto da due righe - pari e dispari
I periodi possono essere costituiti da 2 (primo), 8 (secondo e terzo), 18 (quarto e quinto) o 32 (sesto) elementi. L'ultimo, settimo periodo è incompleto.
Tutti i periodi (tranne il primo) iniziano con un metallo alcalino e terminano con un gas nobile.
In tutti i periodi, con un aumento delle masse atomiche relative degli elementi, si osserva un aumento delle proprietà non metalliche e un indebolimento delle proprietà metalliche. In lunghi periodi, il passaggio delle proprietà dal metallo attivo al gas nobile avviene più lentamente (dopo 18 e 32 elementi) che in brevi periodi (dopo 8 elementi). Inoltre, in brevi periodi da sinistra a destra, la valenza nei composti con ossigeno aumenta da 1 a 7 (ad esempio, da Na a Cl ). In periodi ampi, all'inizio la valenza aumenta da 1 a 8 (ad esempio, nel quinto periodo dal rubidio al rutenio), quindi si verifica un brusco salto e la valenza diminuisce a 1 per l'argento, quindi aumenta di nuovo.
2. Gruppi - colonne verticali di elementi con lo stesso numero di elettroni di valenza, pari al numero del gruppo. Esistono sottogruppi principali (A) e secondari (B).
Sottogruppi principali sono costituiti da elementi di piccole e grandi epoche.
Sottogruppi laterali sono costituiti da elementi di soli grandi periodi.
Nei sottogruppi principali, dall'alto verso il basso, le proprietà metalliche sono migliorate, mentre le proprietà non metalliche sono indebolite. Gli elementi dei gruppi principali e secondari differiscono notevolmente nelle proprietà.
Il numero del gruppo indica la valenza più alta dell'elemento (tranne N, DI ).
Comuni agli elementi dei sottogruppi principale e secondario sono le formule degli ossidi superiori (e dei loro idrati). Per ossidi superiori e il loro elemento idrati I-III gruppi (ad eccezione del boro) predominano le proprietà di base, con da IV a VIII - acido.
|
Gruppo |
III |
VII |
VIII (tranne gas inerti) |
|||||
|
ossido supremo |
E2O |
EO |
E 2 O 3 |
EO 2 |
E 2 O 5 |
EO 3 |
E 2 O 7 |
EO 4 |
|
Idrato di ossido superiore |
EONE |
E(OH) 2 |
E(OH) 3 |
H 2 EO 3 |
H 3 EO 4 |
H 2 EO 4 |
NEO 4 |
H 4 EO 4 |
Per gli elementi dei sottogruppi principali sono comuni le formule dei composti dell'idrogeno. Elementi dei principali sottogruppi I-III i gruppi formano solidi - idruri (idrogeno nello stato di ossidazione - 1) e IV-VII gruppi - gassoso. Composti di idrogeno degli elementi dei principali sottogruppi IV gruppi (EN 4) - neutro, V gruppi (EN 3) - basi, VI e VII gruppi (H 2 E e NE) - acidi.